| イオン泳動実験の問題 | |||||||||||||
| 中学・高校におけるイオンの学習で行われる電気泳動(イオン移動)の実験は、その素材、方法、学習の位置づけなどの点で、指導上困難な教材の一つとなっている。そこで、その問題点を検討し、解決を図ってみた。まず、このイオン泳動の実験を授業で行うには、どんなことを考えなければならないかを挙げてみると、次のようになる。 | |||||||||||||
| ① | イオンの移動を力動的にとらえさせたい。 | ||||||||||||
| ○ | 授業のねらいからいって、「動いていく」とか、「引きつけられていく」という感じが ほしい。 | ||||||||||||
| ○ | ろ紙法、寒天法では、この感じは出せるが、透析膜(セロハン)法、U字管法では、出しにくい。 | ||||||||||||
| ② | 装置、操作が簡単であるか。 | ||||||||||||
| ○ | ろ紙法は、この点で優れている。 | ||||||||||||
| ○ | 寒天法は、寒天を固める準備と片付けが大変である。 | ||||||||||||
| ○ | 透析膜法は、写真9のような装置では、大変である | ||||||||||||
| ○ | U字管法は、工夫によっては装置の準備ができるが、生徒には試料の注入がむずかしい。 | ||||||||||||
| ○ | 塩橋法も、塩橋を作ったり、それに寒天をつめたりする時間がかかる。 | ||||||||||||
| ③ | 実験結果が短時間で観察できる。 | ||||||||||||
| これは、使用する試料の種類(イオンの種類)や電極間にかける電圧などに関係するが、授業では、5分前後で、結果がわかるようでないと、授業が展開しにくい。 | |||||||||||||
| ④ | 電極間電圧は、できるだけ低くしたい。 | ||||||||||||
| 安全面と、装置の準備の面から、できれば、12~15Vで行いたいが、①や③との関係から、これはなかなかむずかしい。高電圧で実験する場合、専用電源を使うことも考えられるが、006P(9V)を直列につないで高電圧にする方が安全である。 | |||||||||||||
| ⑤ | 添加電解質の種類 | ||||||||||||
| 添加電解質を使用しない方がよいのだが、使用しないと、泳動が短時間に見られない。 電解質の種類は、できれば、NaCl など、生徒のなじみ深いものとしたい。 添加電解質としては、塩化ナトリウムのほか、硝酸カリウム、硝酸ナトリウム などがあげられる。また、これらの混合液もいろいろ実験されているが、あまり差がないものもある。 生徒に使用させる場合、単一のものがよい。 |
|||||||||||||
| ⑥ | 添加電解質の電気分解によって起こる電極付近の変化の問題 | ||||||||||||
| 電極付近のこの変化は、さけられないことで、試料電解質の変化に目が向くよう、装置や 方法を工夫しなければならない。特に、酸のH+ 、アルカリのOH- の泳動で、指示薬を使用するときは、十分に留意しておかなければならない。 |
|||||||||||||
| ⑦ | 有色イオン(例えば、MnO4-)、 H+ 、OH- の泳動を観察させたい。 | ||||||||||||
| ⑧ | +イオン と -イオン が同時に移動していることが観察できないか。 | ||||||||||||
| 今のところ、両方のイオンが、一つの電解質で、同時に移動していることが、目で観察できる方法の事例はない。 | |||||||||||||
| 次に、現在、学校で行われているイオン泳動法を分類してみると、次のようになる。 | |||||||||||||
|
|||||||||||||
| 1 ろ紙法 | |||||||||||||
| 装置、方法とも簡便で、生徒が容易にできるので、この方法がよく用いられ、研究データも数多くある。 この方法では、イオンが移動していくようすがわかるが、一つの電解質について、+イオンと、 -イオンが同時に移動していることはわかりにくい。また、移動しているようすを短時間に観察するには、50V以上の電圧が必要である。 |
|||||||||||||
| (1) 方法 | 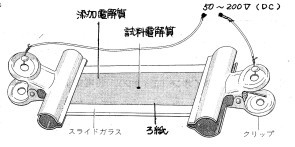 |
||||||||||||
| 図1 | |||||||||||||
| 図1のように、添加電解質(NaCl、KNO3 、 Na2SO4 など)をしみこませた、ろ紙に、試料電解質の結晶などをのせて、電圧をかけると、試料電解質のしみが、+極、-極のどちらかへ移動する。 |
|||||||||||||
| 写真1 | 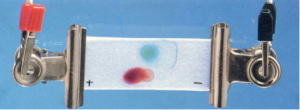 |
||||||||||||
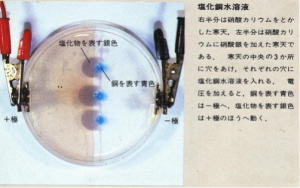
| 写真1は、塩化銅水溶液と過マンガン酸カリウム水溶液(添加電解質 NaNO3) | |||||||||||||
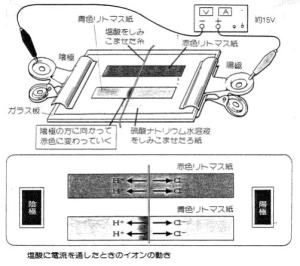
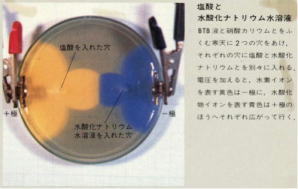
| (2) ろ紙法による H+ とOH- の移動 | |||||||||||||
| 酸、アルカリの指導において、単にイオン式を見比べて、H+ 及びOH- を推論させるだけでなく、H+ 及びOH- のイオン泳動を観察させることによって、指示薬の変化から、生徒は、直観的に、-極に引かれるH+ と酸性の関係を理解でき、+極に引かれるOH-とアルカリ性との関係を理解できるものと思われる。 | |||||||||||||
| H+及びOH- のイオン泳動の場合、添加電解質の電気分解も同時に進むため、電極付近にも呈色反応が見られ(写真2)、そのことの説明で、生徒が混乱させられてしまう。それをさける意味で、電極付近の呈色反応が見られないようにした、図2、3、4の方法は、生徒に試料電解質だけの泳動を注目させるのに有効である。 |  |
||||||||||||
 |
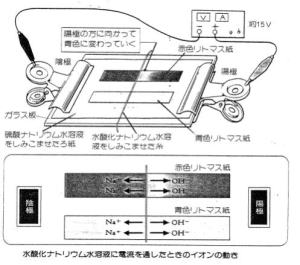 |
||||||||||||
| 2 寒天法 (写真3) | 写真3 ↓ | ||||||||||||
| ろ紙の代わりに寒天を使う方法で、写真3のように、添加電解質を含む寒天上に、試料電解質をおいて電圧をかけ、泳動を観察する。 | 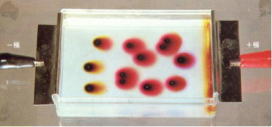 |
||||||||||||
| ろ紙法と同じように、イオンの移動をある程度、力動的に観察できるが、準備する時間がかかり、また、容易にやり直しがきかないので、学校現場の授業の実験には不向きである。 | |||||||||||||
| ◆寒天槽の準備 図10→ | 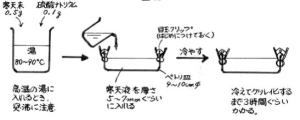 |
||||||||||||
| 寒天液は、0.5%前後がよい。 添加電解質は、種類によって異なるが、0.1~0.2%ぐらいで十分である。 |
|||||||||||||
 |
 |
||||||||||||
| 3 透析膜(セロハン)法 図11 及び 写真6 | |||||||||||||
| 図11のように、陽極室、中央室、陰極室の3つの室に分かれた電解槽を用いる方法で、3つの室は、隔膜(セロハン)で通じている。 中央室に試料電解質水溶液を入れ、左右の室には蒸留水を入れて電圧をかける。 |
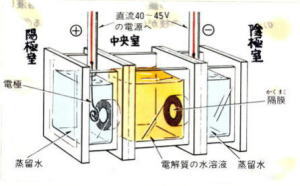 |
||||||||||||
| 例えば、クロム酸リチウムの水溶液の場合、陽極には黄色を示すイオンが移動し、陰極にはリチウムイオンが移動し、これは炎色反応で確認できる。 |
 |
||||||||||||
| この方法は、イオンが電気的に分離できることに特徴があり、イオンが移動していく様子を生徒たちに直感的にとらえさせるには無理がある。 | |||||||||||||
| イオン概念が一応できた段階での検証的実験で、イオン概念導入段階でのイオンのイメー ジづけには、この方法は適当でない。 | |||||||||||||
| 4 U字管法 写真7 | 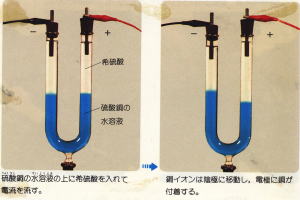 |
||||||||||||
| 写真7のように、U字管に試料電解質を入れ、その上に添加電解質を静かに入れて電流を流す方法で、U字管の左右での試料電解質の高さの差からイオンの移動を推察する。 | |||||||||||||
| ろ紙法や寒天法に比べ、イオンの移動が力動的にややとらえにくいのと、2つ の電解質を分けてU字管に入れるのが、生徒たちには、意外とむずかしいので、生徒実験より、むしろ教師実験に適した方法といえる。 | |||||||||||||
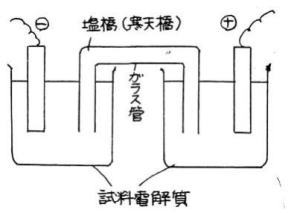
| 5 塩橋法(寒天橋法) | |||||||||||||
| 右下図12のように、2つの電解槽を寒天の入ったガラス管で結び、電圧をかけて電流を流し、寒天の変色のようすを観察するものである。寒天には、添加電解質のほかに、試料電解質によって違った指示薬を加えておく。 | |||||||||||||
|
この方法は、透析膜法の中央室(試料室)と左右の2つの室を、寒天橋を中央室としてつなぎ、 3つの室に分けたといえる。 寒天法と同じく、寒天橋の準備が大変であるが、寒天橋の取り替えだけで済む装置を身近な材料 で作れば、イオンの移動が力動的にとらえられる。 |
|||||||||||||
| 左下写真8~9、及び図13は、フィルムケースを利用して作った、寒天橋式電気泳動装置である。寒天橋が容易に取り替えられるようになっている | |||||||||||||
 |
 |
||||||||||||
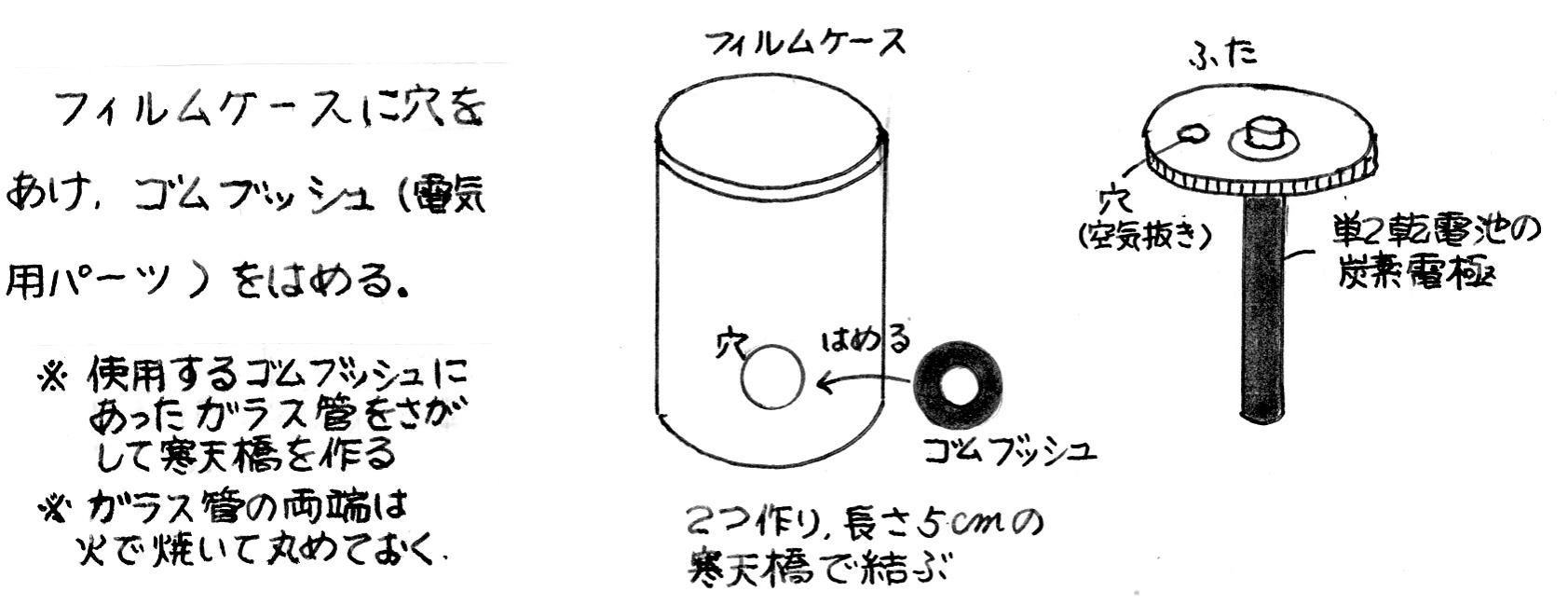 |
 |
||||||||||||
| 6 電源装置のいろいろ | |||||||||||||
| イオンの泳動実験には、電流はわずかでよいが、電圧が高いほど、泳動速度が速く、イオンの移動のようすが力動的に観察できる。 | 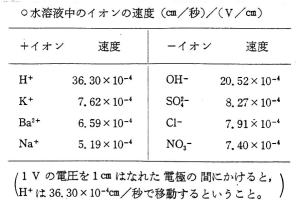 |
||||||||||||
| 電圧のほかに、電極の種類や添加電解質の濃度など、いろいろと研究されているが、学校での実験では、大差はない。 つまり、電極間の距離と電圧に大きく左右される。電極間1cmあたりにかかる電圧が問題となる。(図14-右図) 電圧が高いほど、よい結果が出るにしても、安全面(発熱も考えて)から、そう高い電圧で実験するわけにはいかない。そこで、いろいろと電源を検討してみた。 |
|||||||||||||
| (1) 積層乾電池を使用する。‥‥毎年、用意するとなると高価になる。 | |||||||||||||
| ○ | 006P(9V)積層乾電池を直列に4~5個つなげる。ホックになっているので、つなぎやすい。 | ||||||||||||
| ○ | 67.5V積層乾電池を使用する。 | ||||||||||||
| (2) 理科室に設置されている大型電源装置を使い、DC-30V を各実験台へ送る。 | |||||||||||||
| 高圧にして、大電流が流れるような状態だと危険である。 | |||||||||||||
| (3) 電源装置を各実験台で使用する。 | 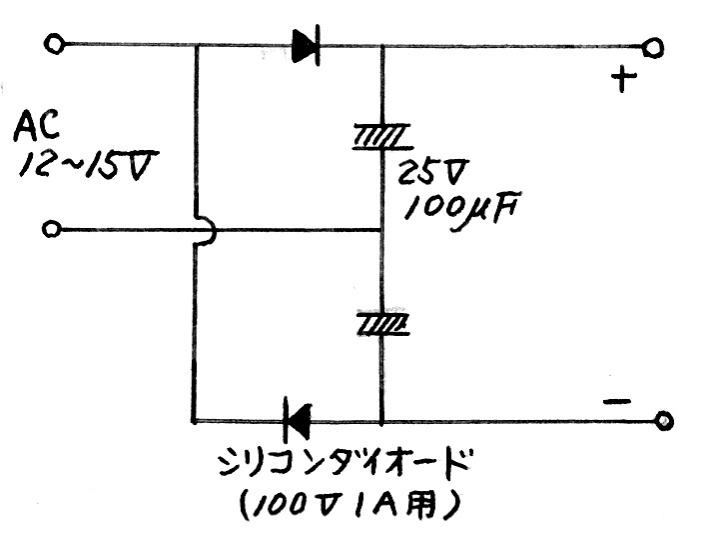 |
||||||||||||
| 図15 | |||||||||||||
| ○ | DC-12~15Vでは、有色イオンの泳動は、なかなか力動的に観察できないが、酸やアルカリでの、H+ 及びOH- の移動は観察できる。 | ||||||||||||
| ○ | 交流端子に、図15の倍電圧整流回路をつなぎ、約DC-30Vを得れば、観察がさらにしやすい。 | ||||||||||||
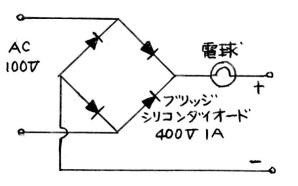
| (4) 家庭用100Vを使う | 図16 ↓ | ||||||||||||
| 家庭用100Vを図16のように整流して使う。 このままでは危険であるから、大電流が流れないように、泳動装置の電極に対して、保護抵抗を直列に入れておく必要がある。保護抵抗としては、5W程度の電球が考えられる。しかし、この方法では、電極間の距離などによって、その間に加わる電圧が大きく変化することになって使いづらい。 |
 |
||||||||||||
| (5) 家庭用100Vを、60V-0.1Aに 下げて使う |
図17 ↓ | ||||||||||||
| 多少、費用がかかるが、小型トランスを購入してAC-100Vを、まず、AC-60Vにさげ、それをブリッジ整流して直流に変える。(図17)小型トランスは、60Vで、0.1Aぐらいのもので、大電流が流れないものを使う。 | 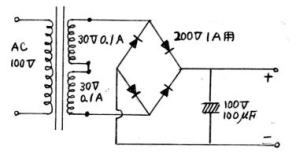 |
||||||||||||
| ※60V-0.1Aの小型トランスは規格にないので、30V-0.1A×2を改造する。 | |||||||||||||